近期,国家药品监督管理局医疗器械标准管理中心发布了《2025年第一次医疗器械产品分类界定结果汇总》文件,在该文件中涵盖了#168个体外诊断试剂产品的分类界定结果,部分产品被检测物质已经有相关的体外诊断检测产品上市,而还有部分检测物质是首次出现,现在针对Ⅱ、Ⅲ类的试剂未出现过的被检测物质进行筛选。
据悉,#器械分类界定 一般是企业无法依据现有的分类目录对新注册的产品进行分类,申请企业向药监部门提出产品分类的需求,国家药品监督管理局医疗器械标准管理中心会定期公示这类相关信息。
从下图可以看到,此次公示的文件中,被检测物质主要分布在其它生化免疫类,基因、蛋白和肿瘤检测相关的产品。目前在国内上市体外诊断试剂中,Ⅱ、Ⅲ类体外诊断试剂产品约四万六千多个注册证,被检测物质数量较多的是蛋白质、其它生化免疫类、酶类和激素类。一般常规的物质会被分类到具体的类别,而新增未被分类的则会被分类到其它生化免疫类。当前体外诊断试剂生产企业接近二千家,因此很多同质化的产品上市,使得市场的竞争异常激烈,发掘新的临床需求是企业开辟市场的一个有效突破口。
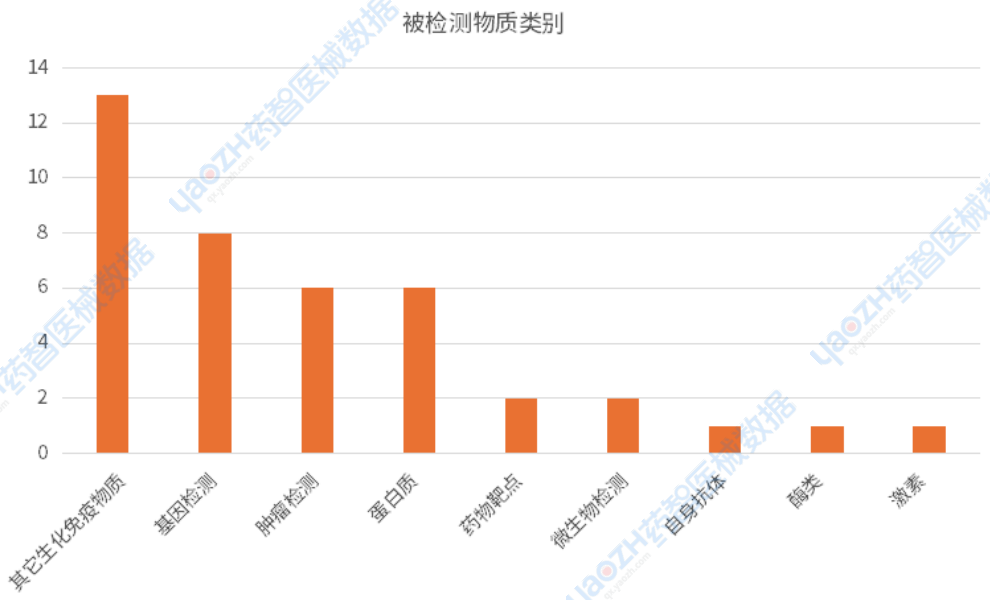
资料来源:医疗器械标准管理中心官网、药智医械数据
从下表可以看到这些新出现的Ⅱ类诊断试剂产品的被检测物质所对应的适应症主要有:眼部免疫、炎症,阿尔茨海默症,尿结石,脓毒症,慢加急性肝衰竭,自身免疫性郎飞结病,细菌感染性疾病及脓血症,血栓性疾病,龋齿,白塞病。
Ⅱ类首款诊断试剂产品
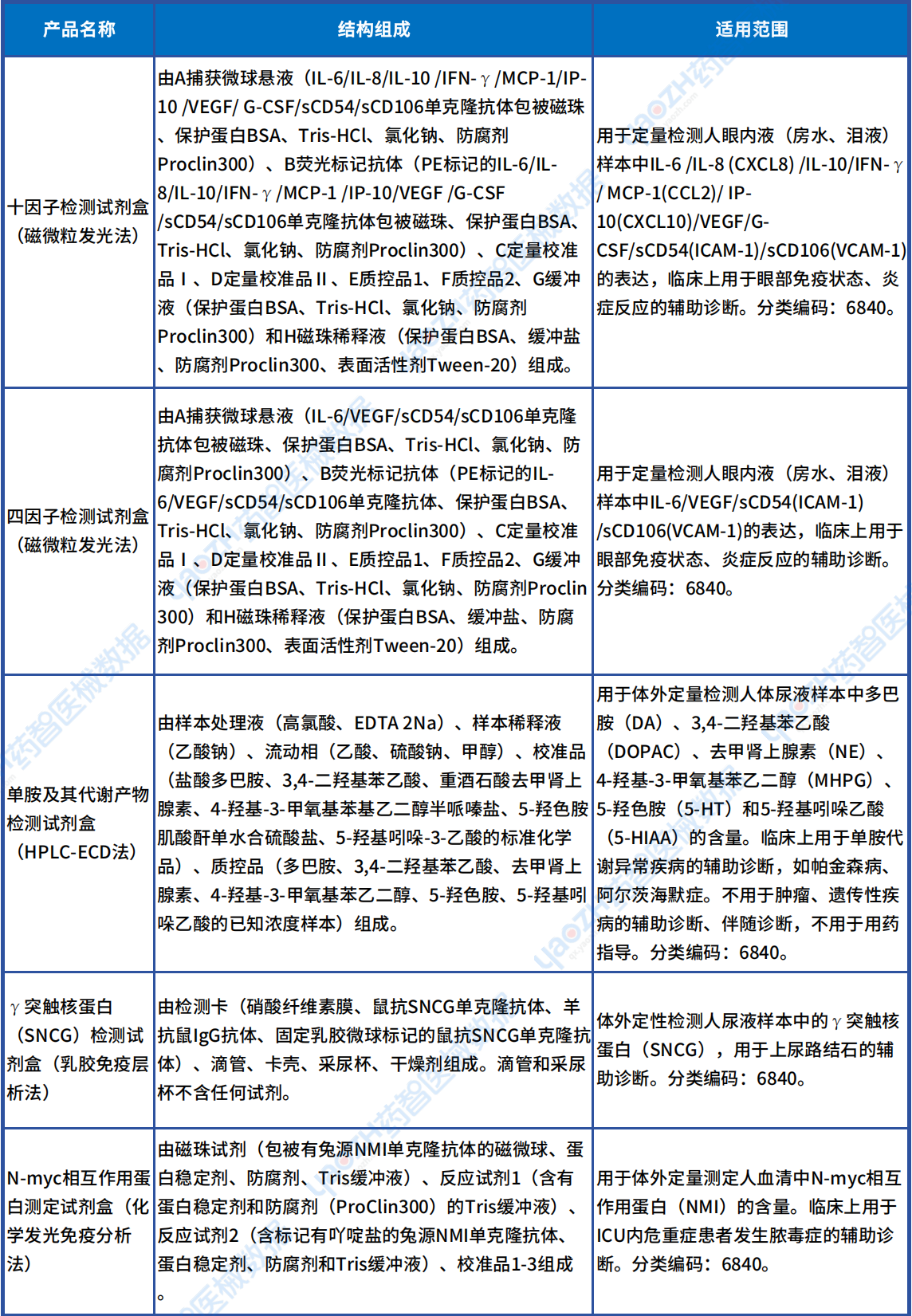
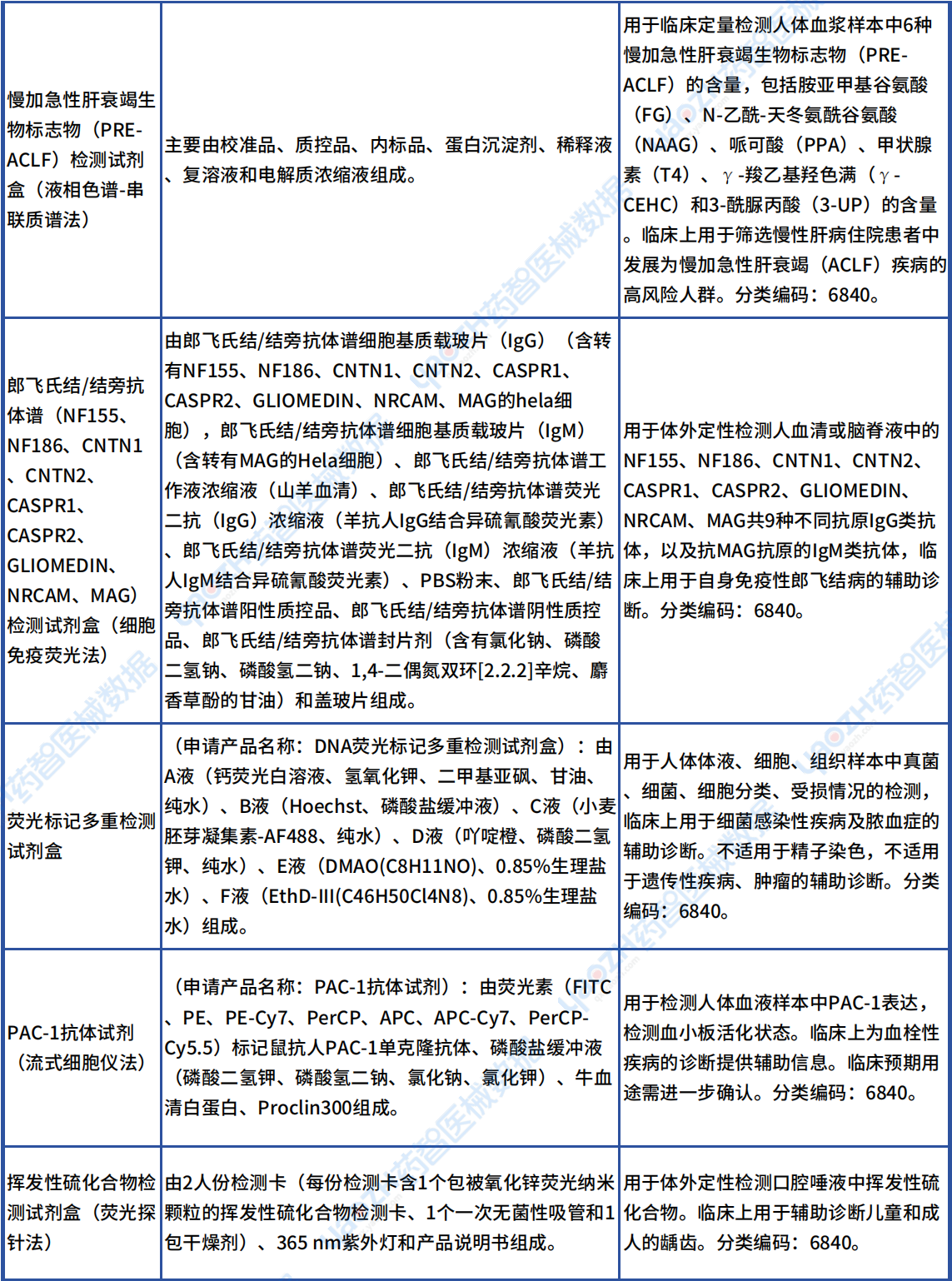

资料来源:医疗器械标准管理中心官网
从下表可以看出,Ⅲ类新出现的检测试剂中有不少是基因检测,主要用于肿瘤以及靶点的检测,这些检测针对的疾病有:B细胞急性淋巴细胞白血病、急性髓系白血病、神经母细胞瘤和髓母细胞瘤等,详情如下。
Ⅲ类首款诊断试剂产品
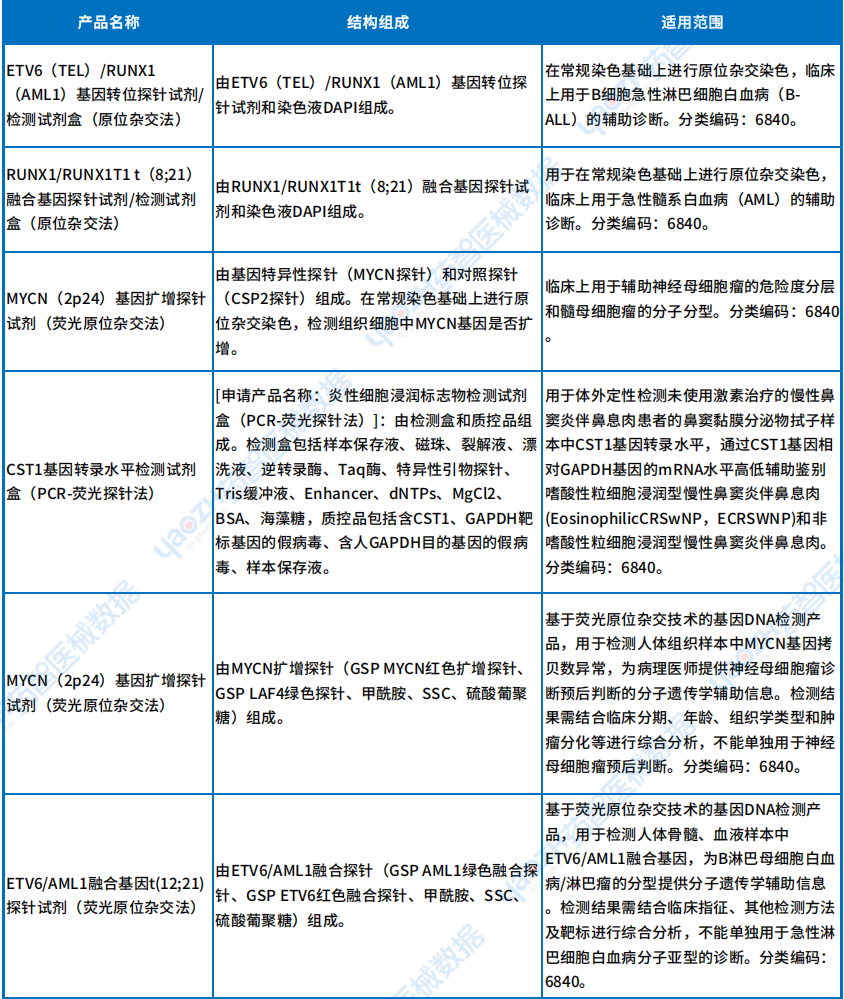
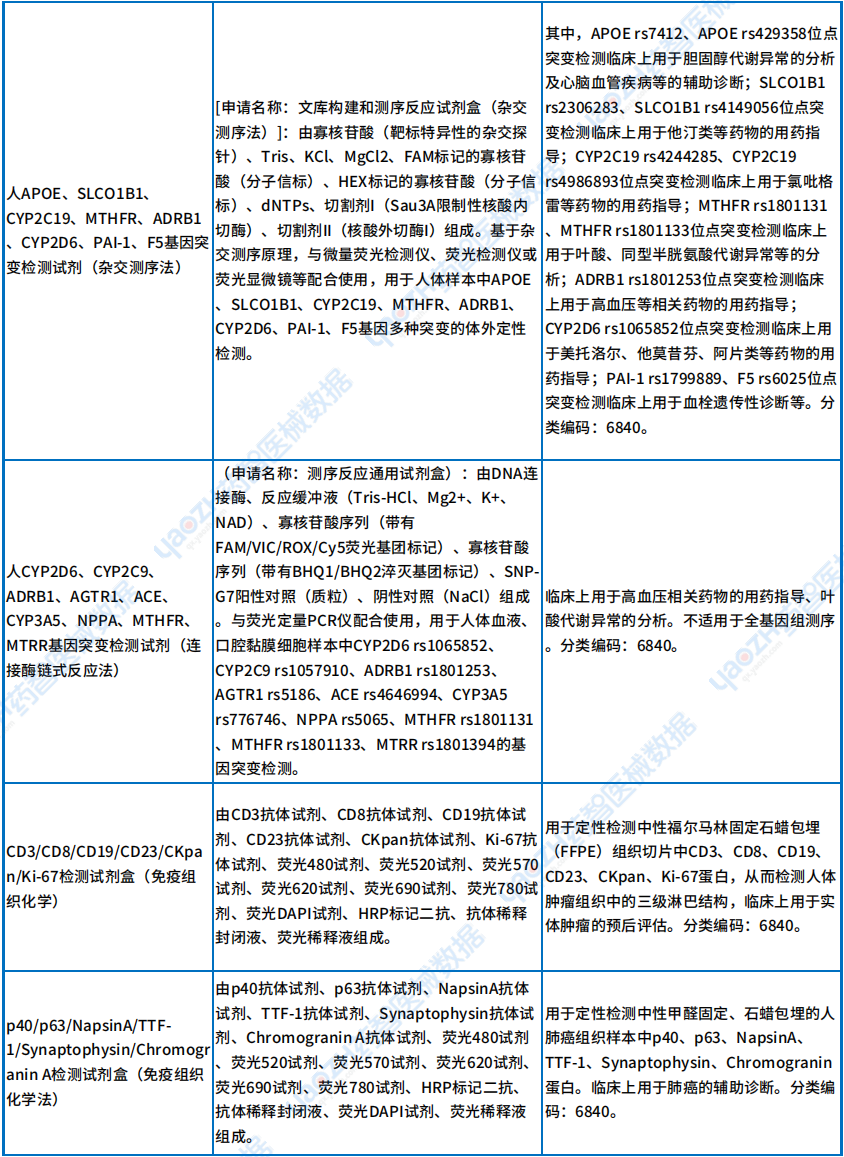
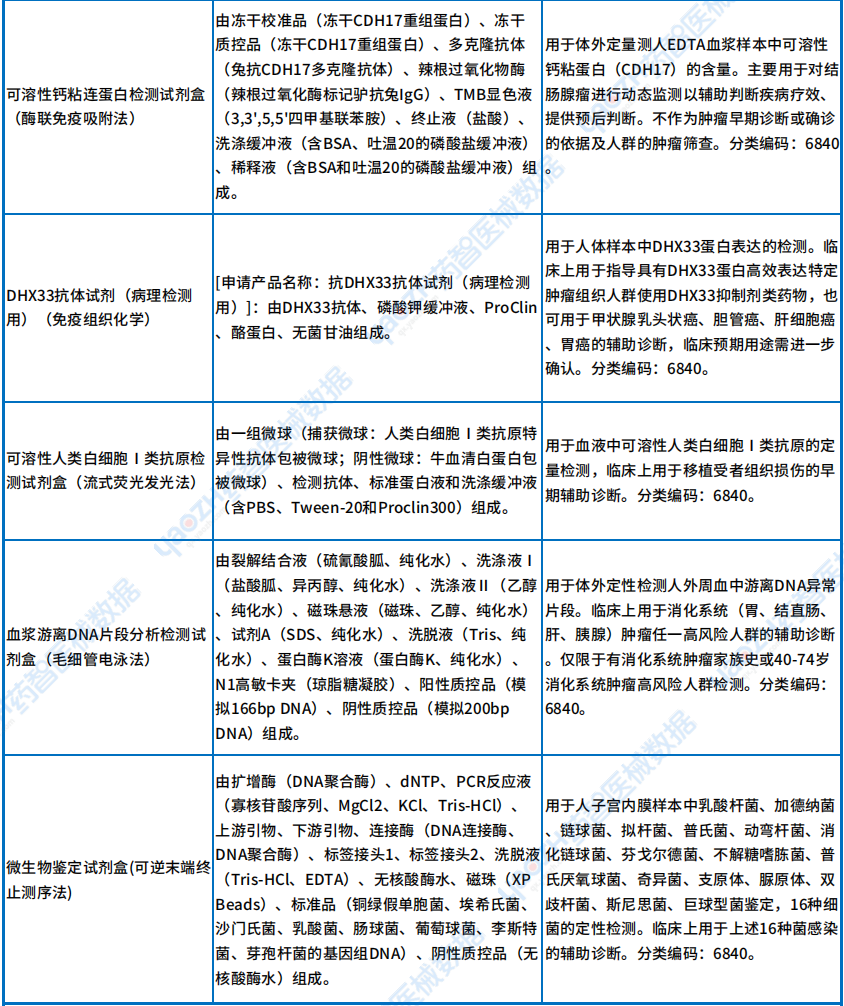
资料来源:医疗器械标准管理中心官网
值得注意的是,企业申请器械产品的分类界定有的是在立项阶段,有的在递交申请资料前。最终有的产品可能没有完成开发,有的可能因为开发不完善导致注册失败。
【来源:药智医械】